Antibiotika-Resistenzen nehmen zu, neue multiresistente Keime entstehen und verbreiten sich. Gleichzeitig sind seit Langem keine neuen Stoffklassen von Antibiotika entwickelt worden. Der Entstehungsprozess von Ribosomen gilt als vielversprechende Zielscheibe für mögliche neue antibakterielle Wirkstoffe. Forschenden der Charité – Universitätsmedizin Berlin sind nun weitere Einblicke in diesen Prozess gelungen. Sie haben erkannt, dass mehrere Helferproteine beim Entstehen der Ribosomen-Bausteine miteinander agieren. Unter ihnen findet sich eines, das den gesamten Prozess anleitet wie ein Dirigent, das Protein ObgE. Dies abzubilden, ist dem Team erstmals gelungen. Die Arbeit ist jetzt im Fachmagazin Molecular Cell erschienen.
„Wir haben es derzeit zufällig mit einer viralen Pandemie zu tun. Die nächste Pandemie kann durchaus bakteriellen Ursprungs sein, weil sich Antibiotika-Resistenzen und sogar multiple Resistenzen rasch über Speziesgrenzen hinweg im Reich der Bakterien ausbreiten“, erklärt Prof. Christian Spahn, Direktor des Instituts für Medizinische Physik und Biophysik der Charité. Er ist der Letztautor der aktuellen Studie.
„Ziel unserer Grundlagenforschung ist es daher, langfristig zur Entwicklung neuer Antibiotika beizutragen.“ Gemeinsam mit Forschenden am Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft (MDC) und an der Universität Konstanz sind die Charité-Wissenschaftler der Frage nachgegangen, wo genau sich in frühen Prozessen der Ribosomen-Entstehung potentielle Angriffspunkte für neue antibakterielle und antimikrobielle Wirkstoffe finden lassen.
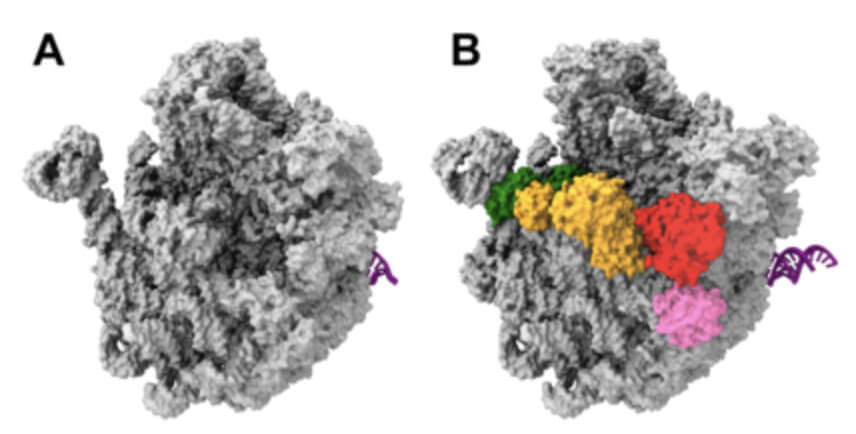 3D-Strukturmodelle von Vorläufern der großen bakteriellen ribosomalen Untereinheit. A) Im Reagenzglas (in vitro) erzeugter Vorläufer-Partikel. B) Der Zelle entnommener Vorläufer-Partikel, der charakteristische Anzeichen seiner natürlichen Herkunft aufweist. Markiert sind die gebundenen Helferproteine: YjgA (grün), RluD (orange), ObgE (rot) und RsfS (pink).Grafik: Nikolay/Charité.
3D-Strukturmodelle von Vorläufern der großen bakteriellen ribosomalen Untereinheit. A) Im Reagenzglas (in vitro) erzeugter Vorläufer-Partikel. B) Der Zelle entnommener Vorläufer-Partikel, der charakteristische Anzeichen seiner natürlichen Herkunft aufweist. Markiert sind die gebundenen Helferproteine: YjgA (grün), RluD (orange), ObgE (rot) und RsfS (pink).Grafik: Nikolay/Charité.
Ribosomen bestehen aus zwei Untereinheiten, einer kleineren und einer größeren. Im Fokus der aktuellen Arbeit des Teams um Dr. Rainer Nikolay, Institut für Medizinische Physik und Biophysik der Charité, stand die große ribosomale Untereinheit des Bakteriums E. coli und ihr Entstehungsprozess. Als mögliches Ziel neuartiger Antibiotika wollten die Wissenschaftler Vorstufen dieser großen Untereinheit – sogenannte Vorläufer – möglichst nativ, also unverändert, isolieren und abbilden.
Es ist nun erstmals gelungen, einen solchen Vorläufer aus bakteriellen Zellen, in diesem Fall E. coli, zu entnehmen und die Molekülstruktur mithilfe kryo-elektronenmikroskopischer Aufnahmen in nahezu atomarer Auflösung darzustellen. „Wir verstehen nun auf molekularer Ebene besser, wenn auch bei Weitem noch nicht vollständig, wie sich die große ribosomale Untereinheit in einer bakteriellen Zelle formiert“, so Erstautor Dr. Nikolay.
Vorläufer von zahlreichen Helferproteinen bedeckt
Um die Bakterienzelle für ihre Beobachtungen so wenig wie möglich zu manipulieren, ist das Forschungsteam quasi minimalinvasiv vorgegangen. Einem Schlüsselspieler im gesamten Prozess der Ribosomen-Entstehung, dem Protein ObgE, wurde eine Markierung angeheftet, ein sogenannter Strep-Tag. Dies geschieht durch einen Eingriff in das Erbgut des Bakteriums, man bezeichnet den Vorgang als Knock-in.
In der Folge produziert das Bakterium ausschließlich markiertes ObgE, das nach rascher Aufbereitung der Zellen elektronenmikroskopisch dargestellt werden kann. So war es erstmals möglich, den gesamten Komplex zu untersuchen, denn das Helferprotein ObgE hat den Vorläufer der großen ribosomalen Untereinheit sozusagen „Huckepack“ dabei. Mit überraschendem Ergebnis, so Dr. Nikolay: „Es stellte sich heraus, dass dieser Vorläufer von zahlreichen Helferproteinen bedeckt ist, die miteinander wechselwirken oder regelrecht kommunizieren. Das Protein ObgE nimmt dabei eine Schlüsselrolle ein, indem es den ganzen Prozess anleitet und orchestriert.“
Möglicher Schritt zu neuen Pharmazeutika
Hier könnten neue Wirkstoffe ansetzen, den Zusammenbau funktionstüchtiger Ribosomen blockieren und somit Bakterienwachstum verhindern. Dieser Schritt war entscheidend, denn um zelluläre Angriffspunkte gänzlich neuer pharmazeutischer Stoffe zu ermitteln, müssen Forschende Unterschiede im Prozess der Ribosomen-Entstehung in Bakterien und in menschlichen Zellen ausfindig machen. „Dem sind wir jetzt ein Stück nähergekommen“, so Dr. Nikolay.
Mit ähnlichen Strategien will das Team nun weitere Einblicke in den Entstehungsprozess bakterieller ribosomaler Untereinheiten erhalten und die molekularbiologischen Abläufe noch besser verstehen.
Dieser Text basiert auf einer Pressemitteilung der Charité – Universitätsmedizin Berlin. Die zugehörige Studie ist im Text und hier verlinkt.
Bildquelle: Lindsay Henwood, unsplash